外显子是人类基因组的蛋白编码区域,虽然外显子区域仅占全基因组1%左右,却包含了85%的人类已知致病突变。全外显子组测序(WES)利用探针捕获技术将全基因组外显子区域DNA捕获富集后进行高通量测序,能够直接发现与蛋白质功能变异相关的遗传变异,结合大量的公共数据库提供的参考序列数据,有利于更好地解释所得变异与疾病的关系。
全外显子组测序与全基因组测序相比,不仅费用更低,数据的解读也相对简单。通过对疾病样本进行全外显子组测序,不仅能快速发现罕见遗传疾病的致病基因,也能用于研究部分疾病的遗传因素,如癌症、糖尿病、高血压等,揭示这些疾病的遗传致病机理。
全外显子组测序是当前的热点技术,极大地推动了疾病研究的进展。本期,小编汇集了近几个月利用WES技术研究各类相关疾病的高分文章,与大家一起分享和学习这一领域的最新研究成果。
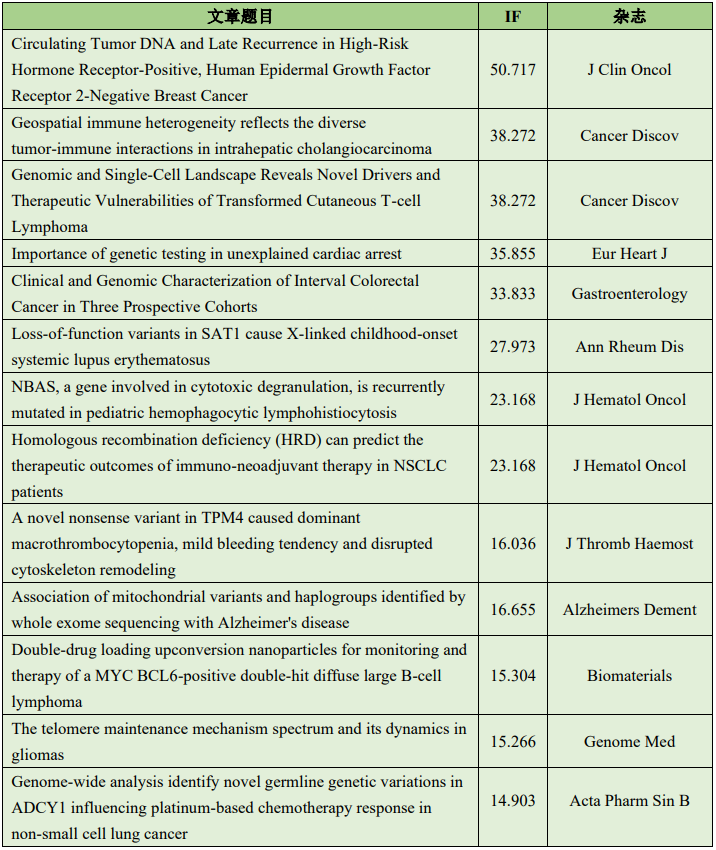
为了探究在诊断后 5 年以上的高危早期激素受体阳性乳腺癌 (HR+ BC) 患者中检查循环肿瘤 DNA (ctDNA) 的流行和动态及其与转移复发的关系。作者招募了 103 名高危 II-III 期 HR+ BC 患者,这些患者在 5 年多前被诊断出没有临床复发证据。实验通过对原发性肿瘤组织进行了全外显子组测序 (WES),以识别通过个性化、肿瘤知情 ctDNA 测试跟踪的体细胞突变,来检测微小残留病 (MRD)。总共 103 名患者中有 85 名有足够的肿瘤组织;其中,85 名患者中有 83 名(97.6%)成功进行了全外显子组测序。个性化 ctDNA 检测针对 36 个变异的中位数设计,以测试 219 个血浆样本。从诊断到第一个样本的中位时间为 8.4 年。中位随访时间为诊断后 10.4 年和首次样本后 2.0 年。每名患者血浆样本的中位数为两个。8 名患者 (10%) 在任何时间点的 MRD 检测呈阳性。6 名患者 (7.2%) 发生远处转移复发,所有患者在明显临床复发前均为 MRD 阳性,中位 ctDNA 提前期为 12.4 个月。一名局部复发患者(1.2%)未发现 MRD。8 名 MRD 阳性患者中有 2 名在最后一次随访中没有出现临床复发。在这项前瞻性研究中,在晚期辅助治疗的高危 HR+ BC 患者中,ctDNA在所有病例发生远处转移前的中位数为1年。未来的研究将确定 ctDNA 指导的 HR+ BC 患者干预是否可以改变临床结果。
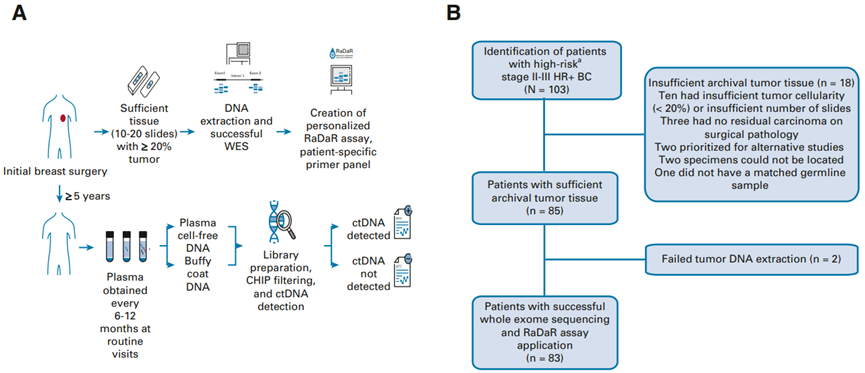
肝内胆管癌 (iCCA) 是全球第二大最常见的原发性肝癌,在世界范围内的发病率不断上升。iCCA 以高侵袭性和术后频繁复发为特点,是人类癌症中死亡率最高的癌症之一。尽管最近针对 IDH1 突变和 FGFR2 融合的新疗法取得了进展,但 iCCA 在大多数情况下仍然是不可治愈的。在这里,作者对45例iCCA患者的207个肿瘤区域进行了WES、RNA-seq、TCR-seq和多重免疫荧光检测。研究结果表明,iCCA 中免疫浸润的多样性,29 例稀疏、异质性或高免疫浸润具有不同的遗传特征和逃逸机制,值得注意的是,FGFR2突变和融合与低突变负担和低免疫浸润相关。免疫基因组学分析的整合为了解 iCCA 的基因组成如何影响免疫蛋白的组成和功能提供了一个新的见解。该研究通过在 iCCA 中整合多组学全面说明了肿瘤-免疫相互作用,展示了患者和肿瘤内的空间异质免疫基因组学特征。未来使用高分辨率空间组学和单细胞分析,能够有助于更好的理解成对的治疗前后样本的研究。基于当前的知识,新的联合免疫疗法最终可能会革新治疗模式并改善这种致命恶性肿瘤的临床结果。
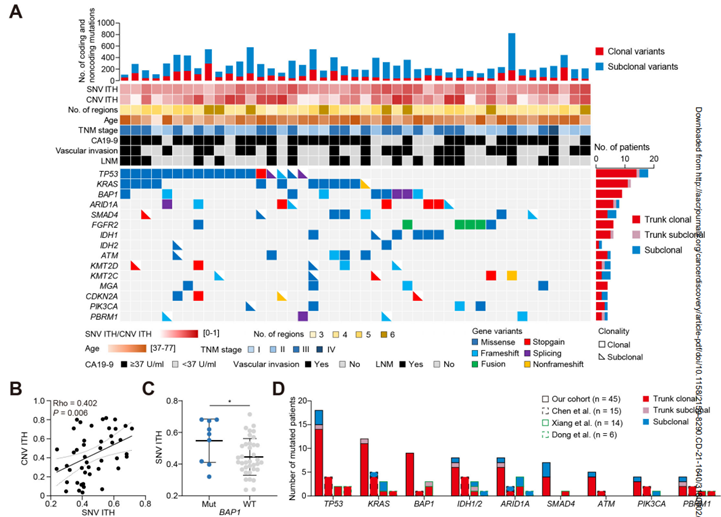
莫菲特癌症中心(Moffitt Cancer Center)的研究人员分享了一项全面的多组学研究,该研究来自一个罕见的队列,包括56名转化CTCL患者,并确定了几个基因组改变和致癌方案,可能是新的潜在治疗靶点。皮肤T细胞淋巴瘤(CTCL)属于非霍奇金淋巴瘤(NHL)中的一种,是原发于皮肤的由T淋巴细胞克隆性增生造成的疾病,近十年来随着人们对淋巴瘤认识的深入,一些新的类型被发现,同时淋巴瘤的分型在不断更新和进步,但是深入的疾病机制仍旧亟待解决。本研究在一个独特的 70 名患者队列中使用跨越全外显子组测序 (WES)、单细胞测序 RNA-seq 和Opal多重荧光免疫分析的综合多组学研究方案,深度解析了CTCL的肿瘤生态系统。研究人员使用70 例皮肤活检的 WES 显示出高肿瘤突变负荷、基于外显子组的驱动特征,皮肤活检的单细胞分析确定了核心致癌流程,其代谢重编程为氧化磷酸化、细胞可塑性、MYC 和 E2F 活性的上调以及 MHC-I 的下调表明肿瘤发生了免疫逃逸。使用 OXPHOS 和 MYC 抑制剂的药理学干扰显示出有效的抗肿瘤活性,而Opal多重荧光免疫分析提供了表达巨噬细胞迁移抑制因子的恶性 T 细胞与表达 CD74 的巨噬细胞和 B 细胞之间通讯的原位分析证据。
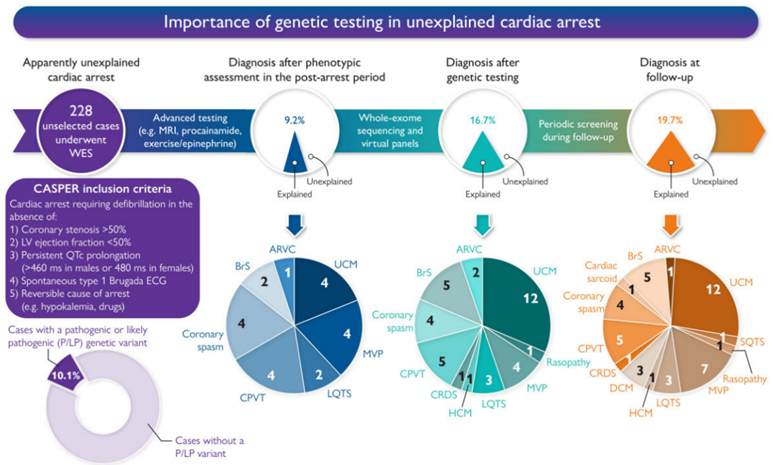
基因检测推荐用于特定的遗传性心脏病,但其作用尚不清楚,目前暂未用于原因不明的心脏骤停(UCA)疾病研究。在此作者试图评估全外显子组测序(WES)在UCA基因检测中的临床应用。首先需要体外除颤的UCA幸存者,包括那些保留射血分数的心脏骤停幸存者。先进行全外显子组测序,然后评估先前报道的心血管疾病基因的罕见变异。共纳入228名UCA幸存者(平均年龄39±13岁)。大多数为男性(66%)和欧洲血统(81%)。进行高级临床试验后,有21/228(9%)例确定了心脏骤停的可能病因。全外显子组测序在23/228(10%)的UCA幸存者中发现了致病性或可能的致病性(P/LP)变异,将表型后的“解释”病例比例从9%增加到与WES相结合时的18%。值得注意的是,23个P/LP变异中有13个(57%)位于与心肌病相关的基因中,在停搏时没有诊断心肌病。基因检测在10%的明显的UCA幸存者中确定了一种致病变异。大多数致病变异位于心肌病相关基因中,在没有明显心肌病诊断的情况下,提示了这些变异导致心律失常的潜在可能性。本研究支持在UCA幸存者中使用包括心律失常和心肌病基因评估在内的基因检测。
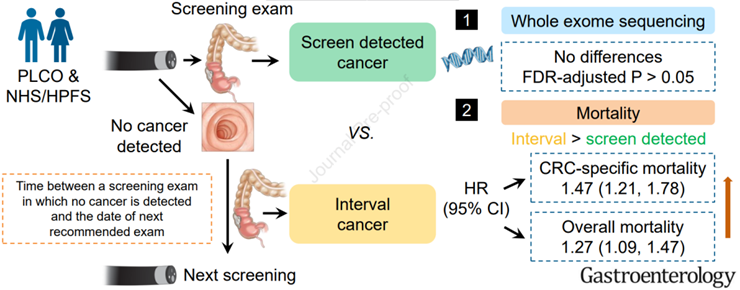
间隔性结直肠癌(CRC)是一种在筛查/监测检查后诊断的癌症,反映了在CRC检测和预防方面前所未有的挑战。为了更好地理解这种特征不佳的CRC变异,作者与筛查检测到的CRC进行了比较,对间隔性CRC的临床和突变特征进行了研究。纳入了1175例在前列腺、肺、结直肠和卵巢(PLCO)癌症筛查试验中记录的CRCs,以及3661例在护士健康研究(NHS)和卫生专业人员随访研究(HPFS)中记录的CRCs。采用多变量Cox模型估计死亡风险的风险比(HRs)和95%可信区间(ci)。对147例PLCO病例和796例NHS/HPFS病例进行了全外显子组测序(WES)。在PLCO和NHS/HPFS随访期间,共确认619例死亡(312例CRC特异性死亡)和2404例死亡(1904例CRC特异性死亡)。与筛查检测到的CRCs相比,间隔性CRCs的特异性死亡率的多变量调整HR (95% CI)为1.47(1.21,1.78),总死亡率为1.27(1.09,1.47)(合并所有三个队列的荟萃分析)。与未被确定的临床预后因素(包括诊断时的分期)解释的筛查发现的CRCs相比,间隔性CRCs的死亡风险显著增加。间隔性CRCs的生存劣势似乎不能用WES特征的肿瘤基因组图谱的差异来解释。
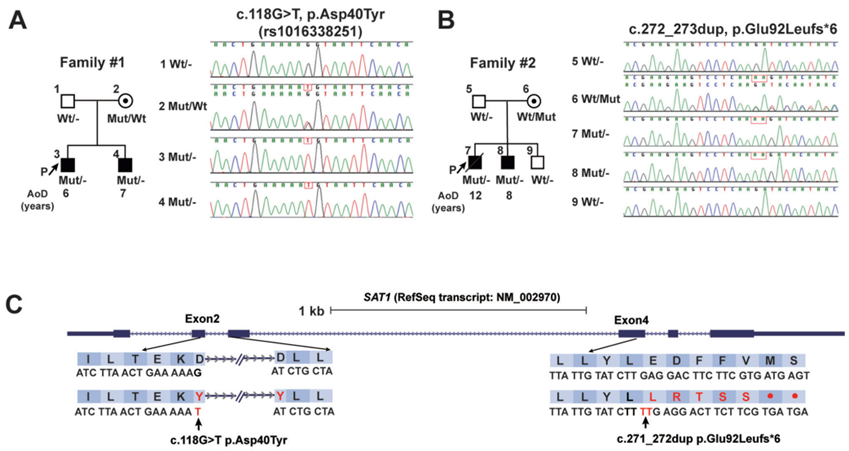
有多个兄弟姐妹的家庭,儿童时期发病的系统性红斑狼疮(SLE)可能有很强的遗传易感性。由此作者通过全外显子组测序(WES)来识别家族性罕见风险变异,并评估它们对狼疮的影响。两个家族性超罕见的、预测功能丧失(LOF) SAT1变异在两个不相关的非裔美国人家庭中表现为x连锁隐性孟德尔遗传。每个LOF变异从不受杂合子影响的母亲传递给两个患有儿童系统性红斑狼疮的儿子。p.Asp40Tyr变异影响剪接供体位点,导致有害转录本的产生。Sat1 p.Glu92Leufs* 6ki半合子雄幼鼠和纯合子雌幼鼠自发性发生脾肿大,肾小球肿大伴白细胞浸润,蛋白尿和I型干扰素诱导基因表达升高。SAT1在中性粒细胞中高度表达,并编码亚精胺/精胺- N1 -乙酰转移酶1 (SSAT1),这是一种多胺分解代谢的限速酶。雄性KI幼鼠出现中性粒细胞缺陷,Foxp3 +CD4+ t细胞亚群比例下降。在未接受治疗的早期SLE患者中,循环中性粒细胞计数和Foxp3 +CD4+ T细胞比例与血浆中精胺水平下降相关。同时发现了两个新的SAT1 LOF变异体,表明移码变异体具有赋予小鼠狼疮的能力,强调了异常多胺分解代谢的致病作用,并确定了SAT1 LOF变异体为SLE的新单基因病因。
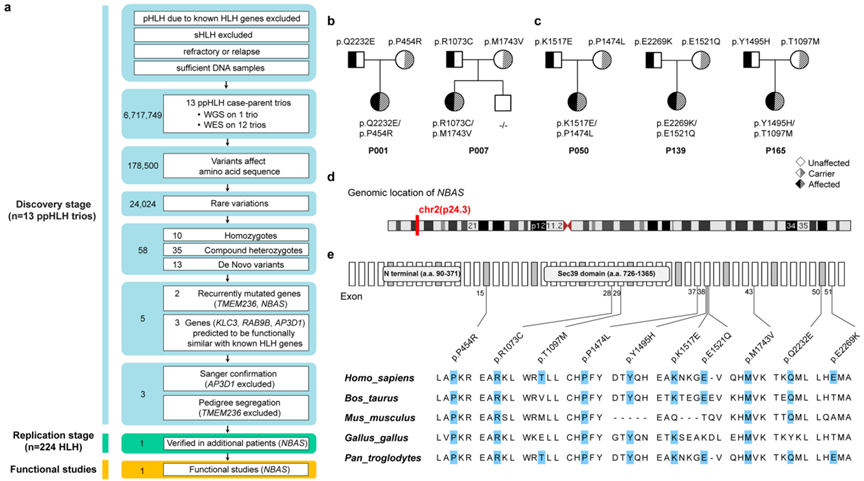
噬血细胞性淋巴组织细胞增多症(HLH),尤其是原发性HLH (pHLH),是一种罕见的、危及生命的疾病。12个已知HLH基因的种系遗传缺陷会损害自然杀伤细胞(NK)或细胞毒性T淋巴细胞(CTLs)的细胞毒性脱颗粒,并有助于pHLH的发展。然而,近10%的HLH患者未发现这些HLH基因的致病突变,这表明HLH的潜在遗传基础仍不清楚。为了发现新的易感基因,Z作者首先选择了13例ppHLH患儿(假设原发性HLH患者,但没有可检测到的已知HLH基因变异)及其父母进行初步筛查。其中一个三人组的全基因组测序(WGS)和12个三人组的全外显子组测序(WES)显示,两名ppHLH患者携带双等位基因NBAS变异体,该基因参与高尔基-内质网(ER)逆行运输的上游脱颗粒途径。此外,在蛋白质相互作用网络分析中,两个候选基因RAB9B和KLC3与已知的HLH基因有直接关系。作者在224例儿童HLH患者的独立验证队列中分析了NBAS、RAB9B、KLC3和已知的HLH基因。在三个没有任何已知HLH基因致病变异的患者中,只发现了双等位NBAS变异。在功能上,NBAS双等位变异患者和NBAS缺陷的NK细胞系均显示nk细胞毒性和脱颗粒受损。利用shRNA敲除NK细胞系(IMC-1)中的NBAS,导致溶解颗粒极化的丧失和高尔基体附近的细胞毒囊泡数量的减少。根据研究结果,NBAS是HLH队列中仅次于PRF1的第二常见突变基因(2.11%)。NBAS缺乏可能通过失调的溶泡运输途径促进HLH的发展。
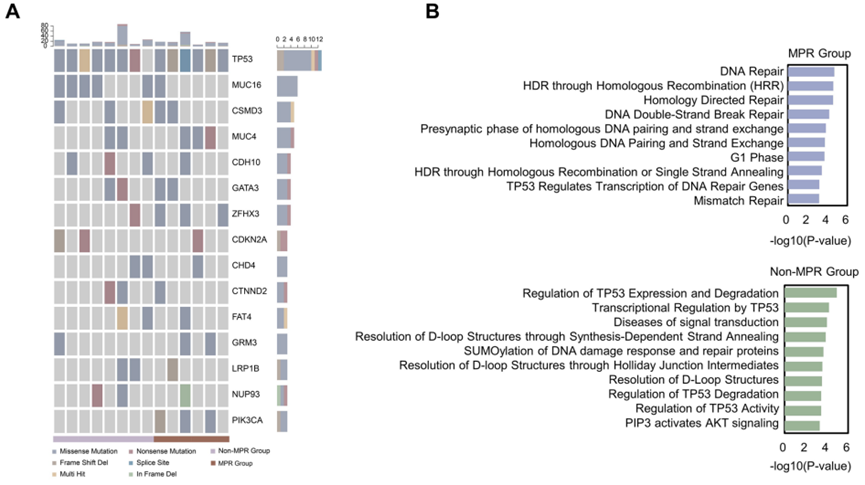
尽管新辅助免疫疗法正在成为肺癌新型有效干预措施,但目前关于预测其疗效的生物标志物研究进展非常有限。本文研究了对新辅助免疫治疗有不同反应的非小细胞肺癌(NSCLC)患者之间的遗传变异,并发现了对疗效有高度提示作用的潜在生物标志物。在本研究中,3例腺癌和11例鳞癌NSCLC患者接受了不同方案的新辅助免疫治疗,随后进行了手术切除。对未经治疗的FFPE或新鲜组织和血液样本进行全外显子组测序(WES),然后对有不同治疗反应的患者之间的遗传变异进行对比。研究结果在多个公共队列数据中进一步得到验证。DNA损伤修复(DDR)相关InDel标记和DDR相关基因突变在治疗反应较好的患者,即主要病理反应(MPR)组中富集。此外,MPR患者还表现出诱发基因组不稳定和独特的同源重组缺陷(HRD)事件。通过进一步检测同源性依赖重组(HR)通路基因的变异状态,克隆变异在MPR组中富集。此外,确定了HR基因变异、存活肿瘤细胞百分比和HRD事件之间的关联,这些关联综合反映在患者的肿瘤突变负荷(TMB)、肿瘤内突变异质性(ITH)、体细胞拷贝数改变(SCNA) ITH和克隆肿瘤抗原负荷中。公共队列的验证进一步支持了该发现的普遍性。本研究首次报道了肺癌中HRD事件与提高的新辅助免疫治疗反应之间的关联。HRD事件在患者不同治疗分层中的作用在多方面的公共队列中持续存在。此后HRD检测或许能成为指导NSCLC患者免疫新辅助和免疫治疗决策的有力工具。
dafabet手机黄金版有着丰富的全外显子捕获测序项目的实验及分析经验,采用定制的Twist Bioscience NGS靶向富集试剂盒,提供高度均一且优化良好的捕获方案,目前已完成15000+例样本的人核心外显子组测序服务。客户只需提供样本,包括细胞、组织、血液、唾液等多种样本,由晶 能生物完成从抽提质检到外显子捕获建库到测序分析的全部流程。













